导语
2021年,中国科学院昆明植物研究所植物化学与天然药物重点实验室肖国志课题组提出了融合试剂调控和远程参与的糖苷化反应策略,进行立体选择性构建1,2-顺式糖苷键。利用该策略,已经实现了α-葡萄糖糖苷键、α-半乳糖糖苷键、1,2-顺式阿拉伯吡喃糖糖苷键和α-2-脱氧-2-乙酰氨基葡萄糖糖苷键的高度立体选择性构建。最近,作者进一步扩展该策略,实现了α-GalNAc糖苷键的高立体选择性构建,并应用于黏蛋白相关肿瘤碳水化合物抗原的集群式合成(图1)。相关研究成果发表在Chemical Science 2024, DOI:10.1039/D4SC01348D。
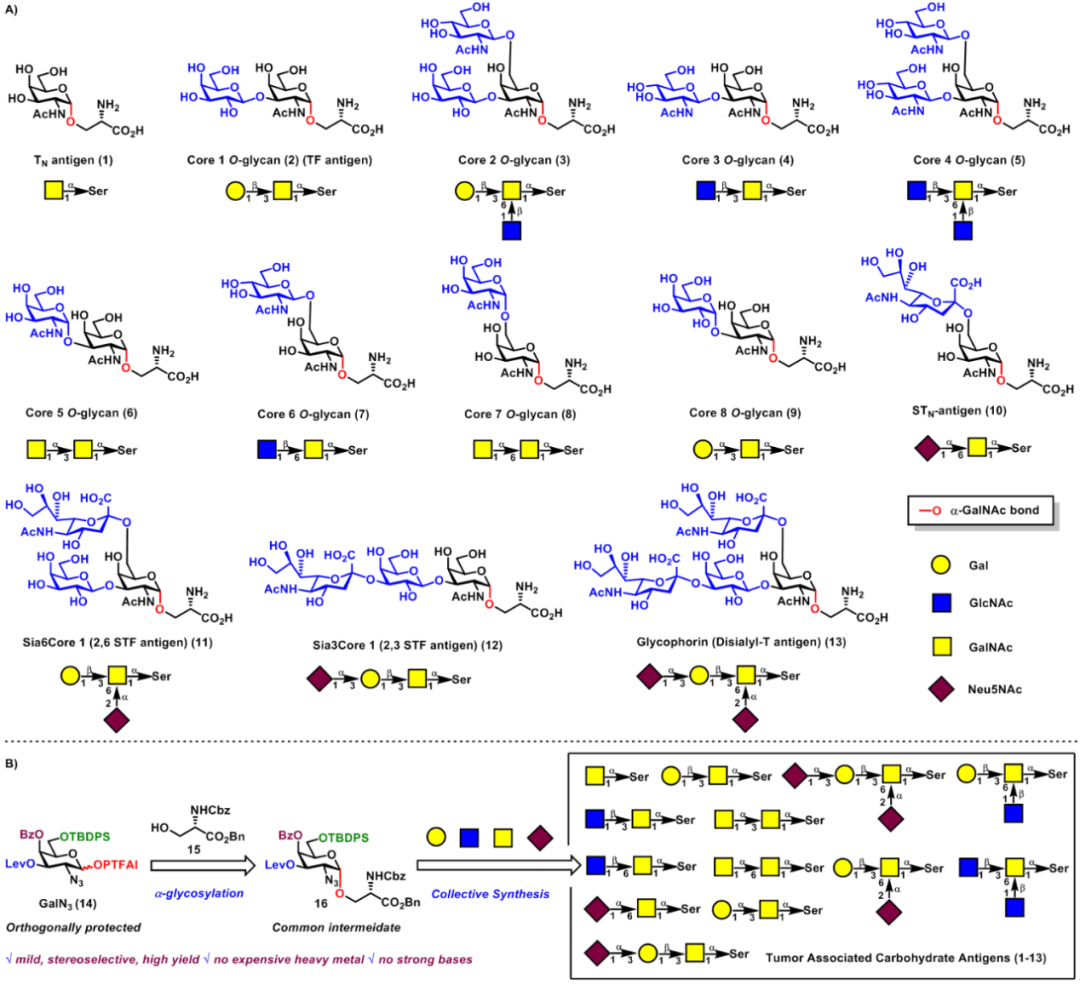
图1(来源:Chem. Sci.)
前沿科研成果
以GalN3为给体的高度立体选择性α-糖苷化方法完成了黏蛋白相关肿瘤相关碳水化合物抗原的集群式合成
首先,作者研究了3位、4位和6位不同保护基的GalN3 N-苯基三氟乙酰亚胺酯(PTFAI)为给体和HO(CH2)5NBnCbz强亲核试剂为受体,TMSI和Ph3P=O试剂组合为促化剂的糖苷化反应,探究给体不同保护基对糖苷化反应立体选择性的影响(图2)。结果表明:当C3和C4位为Bz保护基时,α-立体选择性和产率最优(Entry 1)。并且,C3和C4位为Bz保护基的给体比C3和C4位为Ac保护基的给体在反应中具有更好的α-立体选择性和更高的产率(Entry 9-18)。另外,C4位Bz保护基比C3位Bz保护基对糖苷产物的立体选择性影响更大(Entry 5-6)。
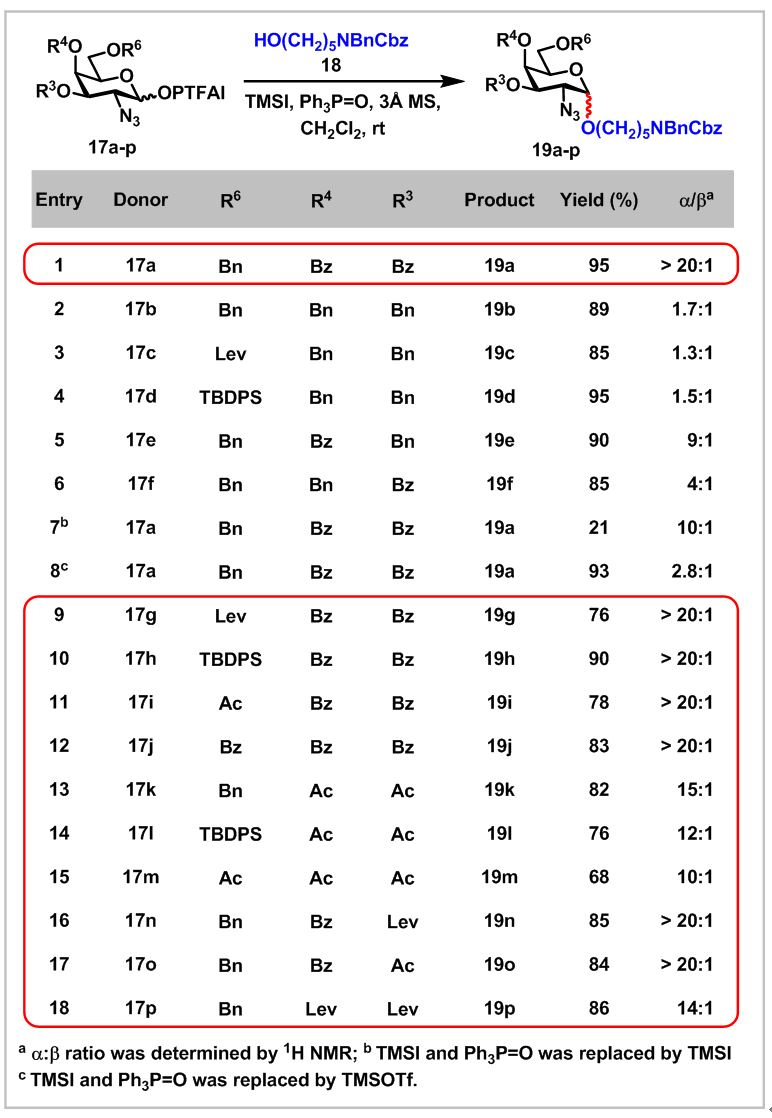
图2(来源:Chem. Sci.)
在得到最佳反应条件后,作者考察了以GalN3 PTFAI 17a为给体的立体选择性α-糖苷化受体范围(图3)。当受体为链状脂肪族伯醇时,糖苷化反应都以优异的产率(86%-95%)和立体选择性得到产物(α/β>20:1)。当受体为糖基伯醇,如半乳糖、甘露糖、葡萄糖和阿拉伯糖时,糖苷化反应同样以优异的产率(86%-99%)和立体选择性得到产物(α/β>20:1)。受体为糖基仲醇受体时,糖苷化反应的产率(86%-99%)和立体选择性也可以达到较高的水平(90%-99%)。作者还考察了受体为氨基酸的反应情况。受体为L型丝氨酸(20n-p)时,糖苷化反应以中等收率(73%)和高的立体选择性(α/β>20:1)得到产物。另外,受体为薄荷醇、金刚烷醇、胆固醇等生物活性物质或天然产物,反应仍然以高的产率和立体选择性得到产物。
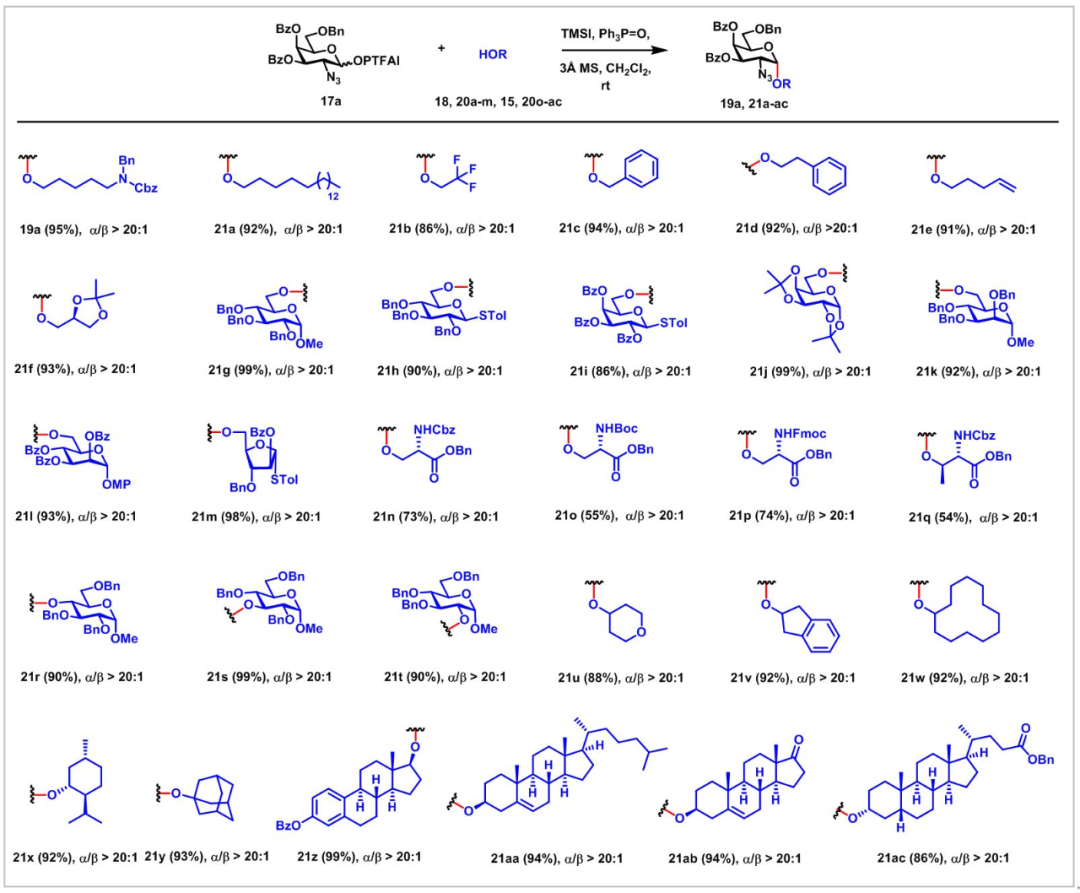
图3(来源:Chem. Sci.)
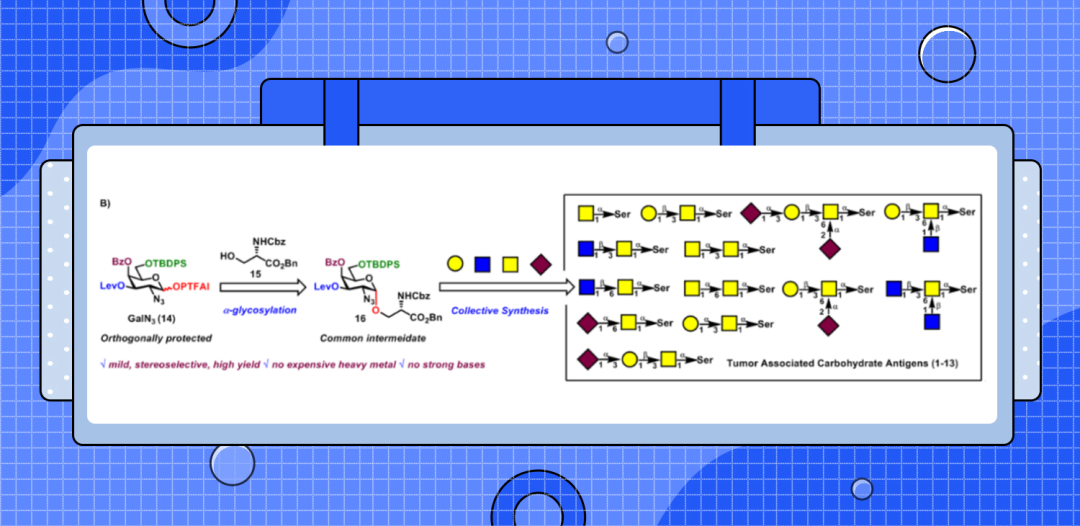
接下来,作者研究了这种α-糖基化方法在粘蛋白型O-聚糖集群式合成中的应用(图4-5)。在室温下,在TMSI和Ph3PO存在下,策略性保护的GalN3-PTFAI供体14与丝氨酸15的偶联顺利进行,以可接受的60%产率和优异的立体选择性(α/β>20:1)得到了所需的中间体GalN3-α-O-Ser 16,其作为合成所有粘蛋白型O-聚糖1-13的共同中间体,并且此反应可以达到克级规模。从中间体GalN3-α-O-Ser 16经过各种官能团转化及糖苷化反应合成TACA,包括TN抗原、STN抗原、2,3-STF抗原、2,6-STF抗原、血型糖蛋白抗原(glycophorin)和核1-8黏蛋白型O-聚糖。
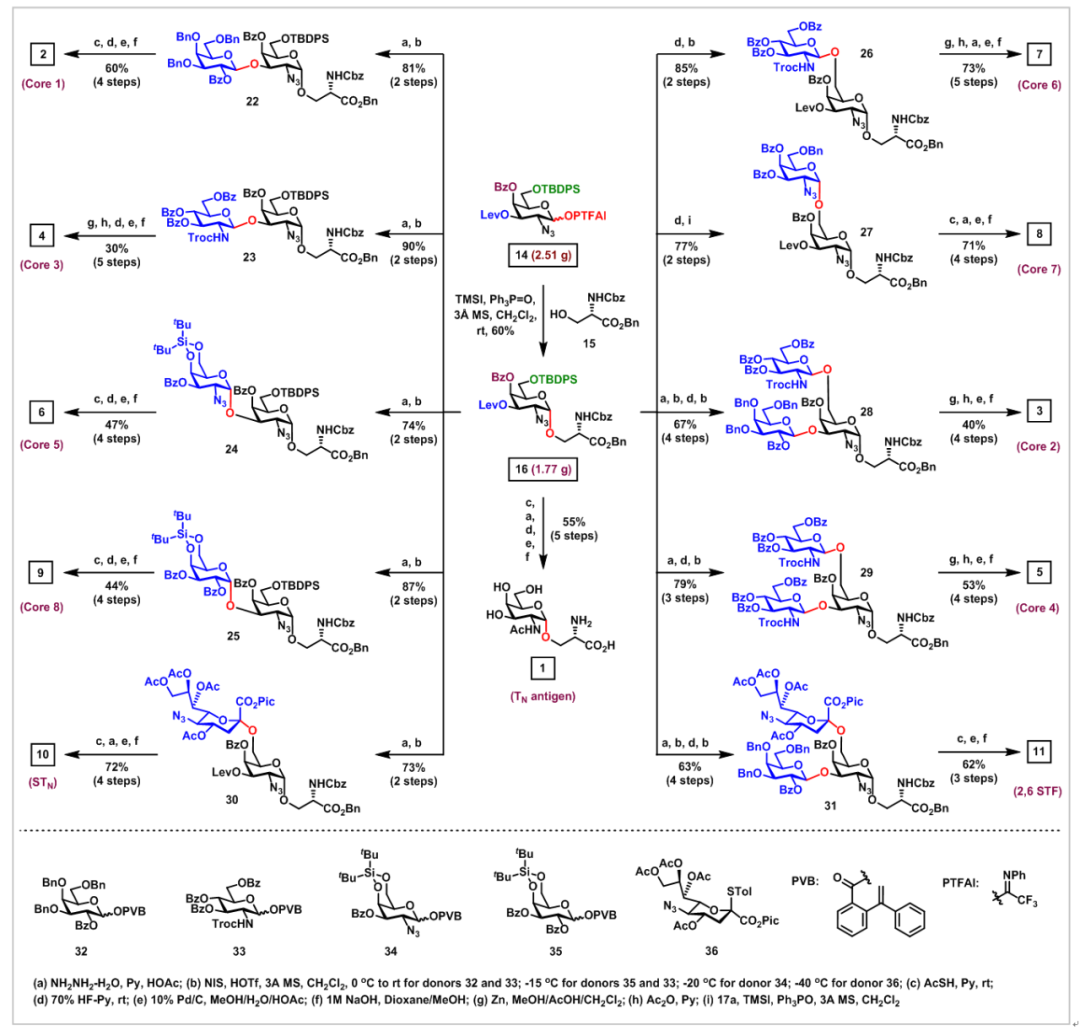
图4(来源:Chem. Sci.)
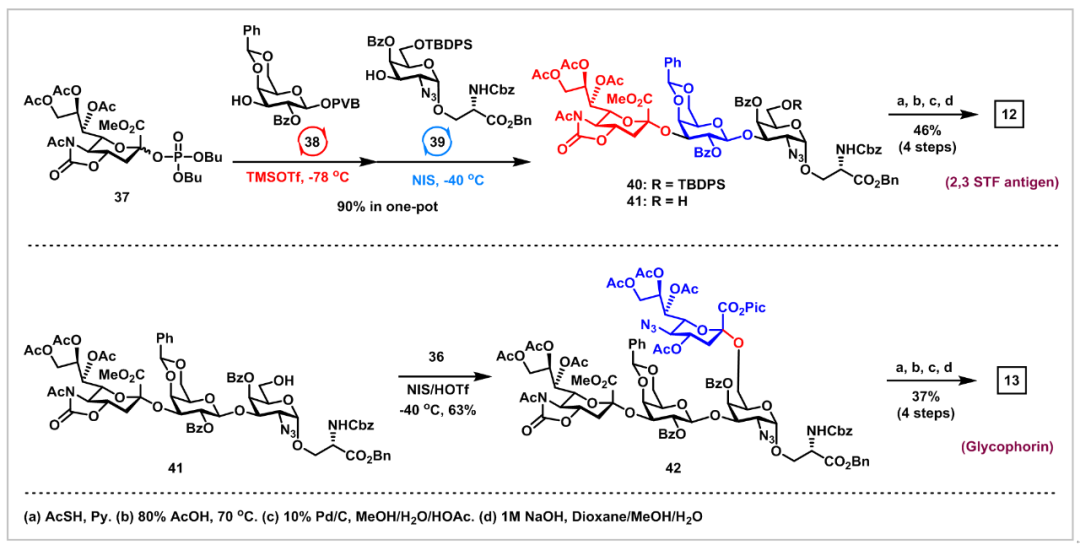
图5(来源:Chem. Sci.)
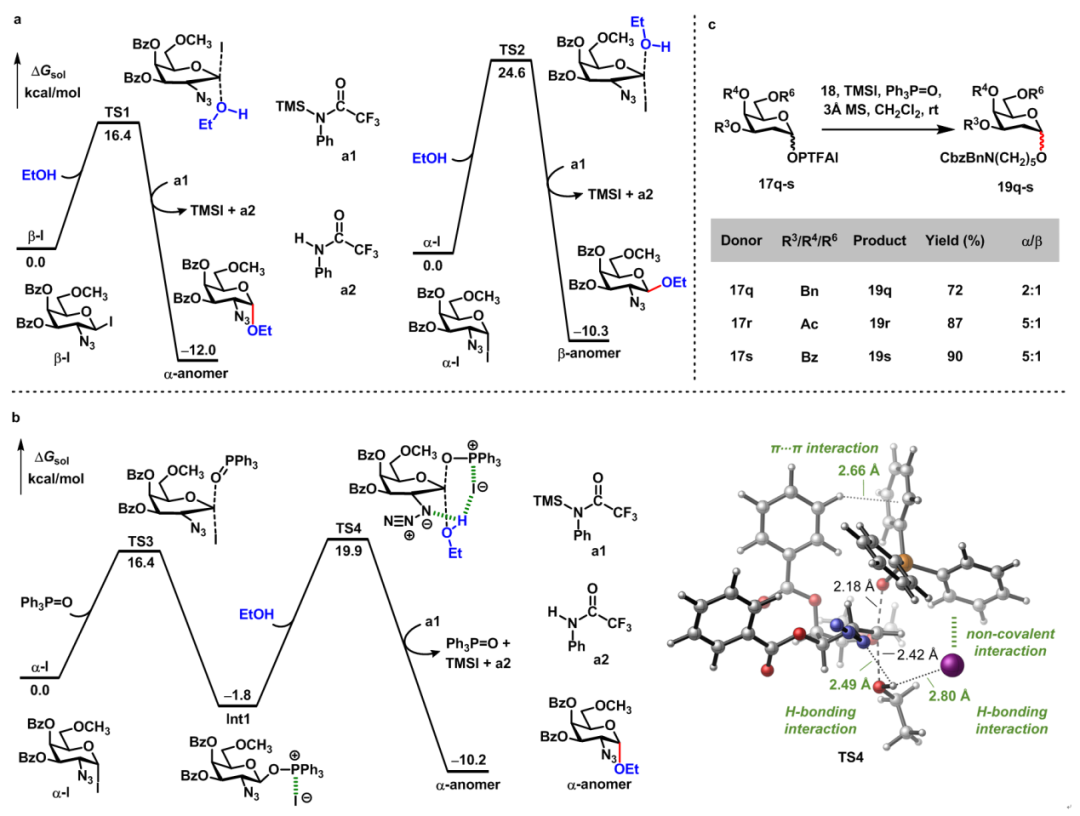
图6(来源:Chem. Sci.)
最后,肖国志课题组和山东大学陆刚课题组合作进行密度泛函理论计算,对反应机理进行研究。发现:1)在没有Ph3P=O存在下,亲核试剂对β-碘苷的SN2反应能垒要比对α-碘苷的SN2反应能垒低得多(ΔG‡ = 8.2 kcal/mol)(图6a),这也解释了只有TMSI为促进剂时(α-碘苷/β-碘苷= 4:1),只得到21%产物(α/β = 10:1)(Entry 7,图2);2)在TMSI和Ph3P=O存在下,Ph3P=O可以将α-碘苷转化为β-碘化膦中间体Int1,亲核试剂对β-碘化膦中间体Int1进行SN2反应生成相应的产物(图6b),该反应能垒要比对α-碘苷的SN2反应能垒低(ΔG‡ = 2.9 kcal/mol)。值得一提的是,碘化膦中间体Int1可以被高分辨质谱检测到。另外,当2-脱氧半乳糖PTFAI给体17q-s和受体18在标准条件下进行糖苷化反应时,糖苷化产物立体选择性较低(图6c),这也进一步佐证了醇亲核试剂可以与叠氮基团形成氢键作用,实现SN2反应(图6b)。
总结,作者报道了α-GalNAc糖苷键的高立体选择性构建方法。该方法具有优异的产率、突出的立体选择性、宽的底物范围和温和的反应条件。该方法成功应用于黏蛋白相关肿瘤碳水化合物抗原的集群式合成,包括:TN抗原、STN抗原、2,6-STF抗原、2,3-STF抗原、糖蛋白,血型糖蛋白抗原(glycophorin)和1-8核心粘蛋白型O-聚糖。特别的是,通过密度泛函理论计算和机理研究,首次揭示了该立体选择性糖苷化反应的反应机理,阐明了试剂(TMSI和Ph3PO)组合的关键作用和叠氮基团氢键导向的作用。
该研究成果以“Highly stereoselective α-glycosylation with GalN3 donors enabled collective synthesis of mucin-related tumor associated carbohydrates antigens”为题发表于英国皇家化学会旗舰期刊Chemical Science。该工作的通讯作者为肖国志研究员和陆刚教授,第一作者为首坤秀博士研究生、张云琴博士和嵇玉洁博士研究生。该研究成果得到了国家自然科学基金优秀青年基金和面上项目等的大力资助。